Estequiometria na Vida Real: Aplicações Práticas: Exemplo De Problema Da Vida Real Usado Para Ensinar Estequiometria
Exemplo De Problema Da Vida Real Usado Para Ensinar Estequiometria – A estequiometria, o estudo das relações quantitativas entre reagentes e produtos em reações químicas, transcende os limites da teoria e encontra aplicações práticas em diversos setores da nossa vida. Compreender os princípios estequiométricos é fundamental para otimizar processos industriais, prever o impacto ambiental de reações e até mesmo para o preparo de receitas culinárias. Neste artigo, exploraremos exemplos concretos de como a estequiometria se manifesta no cotidiano, desde a produção de fertilizantes até a combustão de combustíveis.
Produção de Amônia (Processo Haber-Bosch), Exemplo De Problema Da Vida Real Usado Para Ensinar Estequiometria
O processo Haber-Bosch, crucial para a produção de amônia (NH₃), um componente fundamental de fertilizantes, ilustra perfeitamente a importância da estequiometria. A equação balanceada para a síntese de amônia é: N₂ + 3H₂ → 2NH₃. A partir de uma determinada quantidade de nitrogênio e hidrogênio, podemos calcular a quantidade teórica de amônia produzida, considerando o reagente limitante, que é aquele que se esgota primeiro, determinando a quantidade máxima de produto formado.
Na prática, o rendimento real é menor que o teórico devido a diversos fatores, como condições de temperatura e pressão não ideais, e a presença de reações secundárias.
| Reagentes | Produtos | Quantidade Inicial (mol) | Quantidade Final (mol) |
|---|---|---|---|
| N₂ | NH₃ | 10 | 0 |
| H₂ | 30 | 10 |
Combustão de Metano

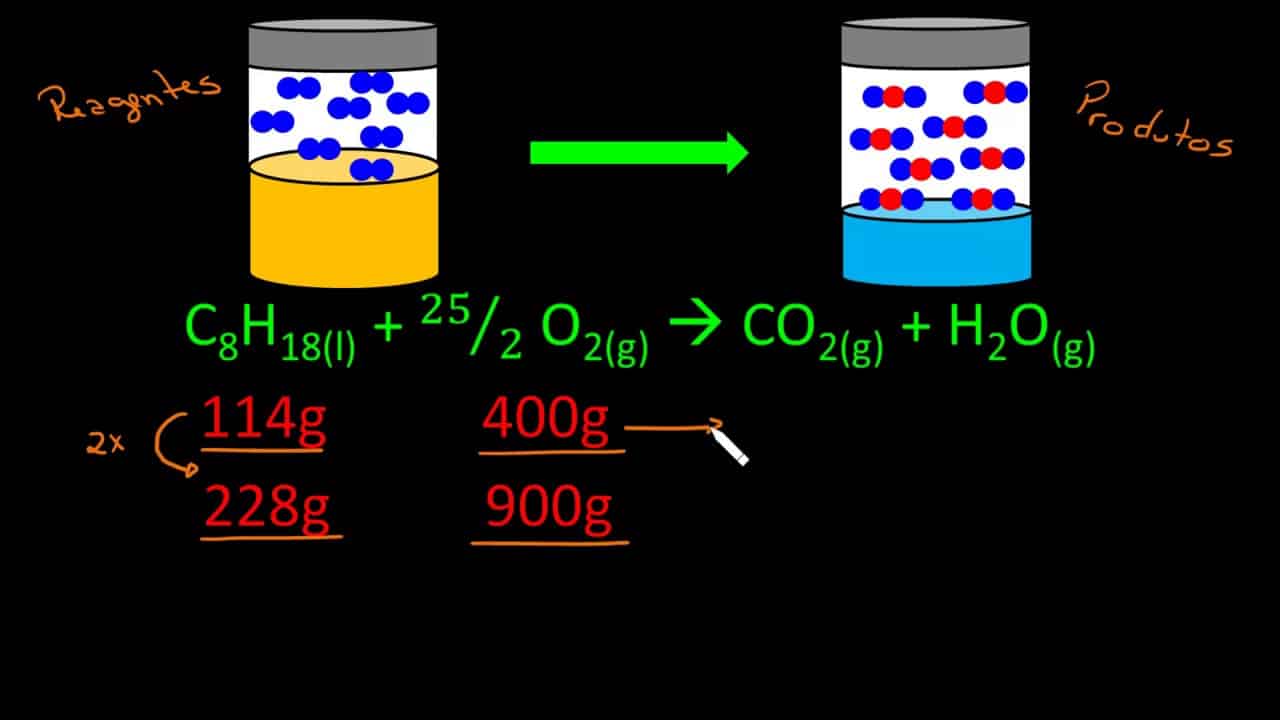
A combustão completa do metano (CH₄), um principal componente do gás natural, é representada pela equação: CH₄ + 2O₂ → CO₂ + 2H₂O. A queima de uma determinada massa de metano produz uma quantidade específica de dióxido de carbono (CO₂), um gás de efeito estufa. A estequiometria permite calcular essa quantidade, destacando a relação direta entre a combustão de combustíveis fósseis e a emissão de gases que contribuem para as mudanças climáticas.
Um diagrama simples ilustraria a reação: uma molécula de metano reagindo com duas moléculas de oxigênio para formar uma molécula de dióxido de carbono e duas moléculas de água. A visualização da reação evidencia o consumo dos reagentes e a formação dos produtos.
Reação de Neutralização Ácido-Base
A titulação ácido-base é um procedimento comum em laboratórios que demonstra a aplicação da estequiometria em soluções aquosas. Consideremos a reação entre um ácido forte (ex: HCl) e uma base forte (ex: NaOH): HCl + NaOH → NaCl + H₂O. A estequiometria permite calcular o volume de uma solução de ácido de concentração conhecida necessário para neutralizar um volume específico de uma solução de base de concentração conhecida.
O procedimento envolve a adição gradual do ácido à base, utilizando um indicador para determinar o ponto de equivalência, onde a quantidade de ácido adicionada é estequiometricamente equivalente à quantidade de base presente.
| Volume (mL) | Concentração (mol/L) | Ácido | Base |
|---|---|---|---|
| 25 | 0.1 | HCl | NaOH |
- Medir o volume da solução de base.
- Adicionar o indicador.
- Adicionar o ácido gradualmente, agitando constantemente.
- Observar a mudança de cor no ponto de equivalência.
- Registrar o volume de ácido utilizado.
Reação de Síntese: Produção de Polietileno
A produção de polímeros, como o polietileno, ilustra a estequiometria em reações de síntese. A polimerização do eteno (C₂H₄) envolve a ligação de numerosas moléculas de eteno para formar longas cadeias de polietileno (-CH₂-CH₂-)n. A estequiometria permite calcular a quantidade de polietileno produzida a partir de uma determinada quantidade de eteno, considerando o rendimento da reação. A comparação entre diferentes métodos de síntese revela variações na eficiência e no impacto ambiental, com a busca constante por processos mais sustentáveis.
Um fluxograma poderia mostrar a transformação do eteno em polietileno, com etapas de iniciação, propagação e terminação da cadeia polimérica.
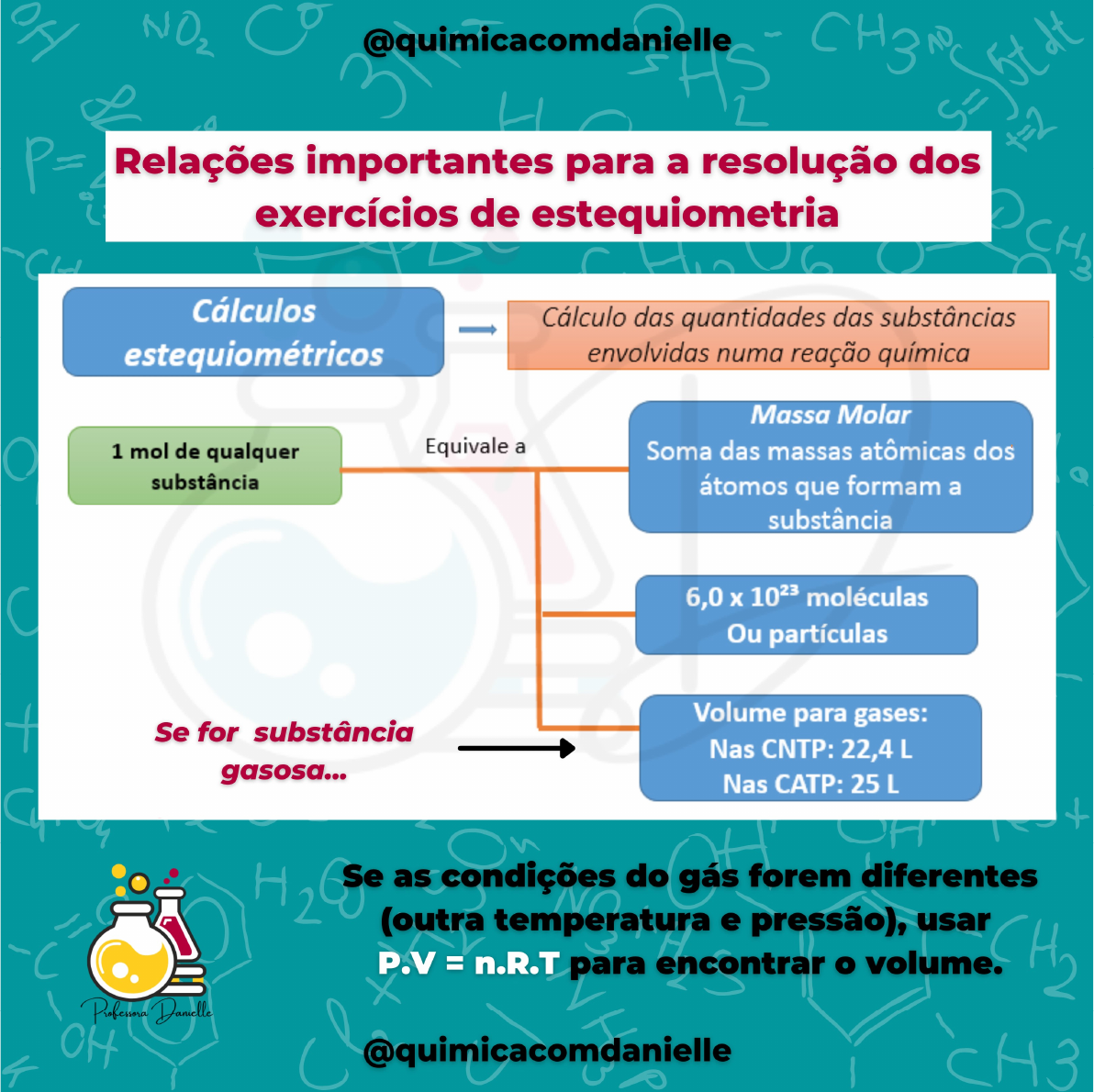
Compreender a estequiometria vai além de dominar equações e fórmulas; trata-se de adquirir uma ferramenta poderosa para analisar e interpretar o mundo ao nosso redor. De processos industriais de larga escala às reações químicas mais simples, a estequiometria oferece uma perspectiva quantitativa crucial. Os exemplos apresentados – desde a produção de amônia até reações ácido-base – ilustram a abrangência e a importância desta área da química, mostrando como cálculos aparentemente abstratos se traduzem em resultados concretos com implicações significativas na nossa sociedade.
A capacidade de prever quantidades, otimizar processos e avaliar impactos ambientais são habilidades essenciais para qualquer profissional que lide com transformações químicas, reforçando a relevância do estudo da estequiometria como base para uma compreensão mais profunda da ciência e da tecnologia.

