As Enzimas São Exemplo De Que Tipo De Estrutura Proteica? Essa pergunta, aparentemente simples, nos leva a um mundo fascinante de proteínas dobradas de maneiras mirabolantes, capazes de realizar tarefas incríveis no nosso corpo. Imagine proteínas como legos moleculares: algumas são tijolos retos e compridos (fibrosas), outras são bolinhas complexas e intrincadas (globulares), e as enzimas? Bem, elas são as arquitetas mestras, as estrelas do show molecular, responsáveis por quase tudo que acontece dentro de nós, desde a digestão até o pensamento! Prepare-se para uma jornada bioquímica repleta de surpresas, onde desvendaremos os segredos dessas pequenas máquinas maravilhosas.
As enzimas, como todas as proteínas, são polímeros de aminoácidos, organizados em estruturas complexas que ditam sua função. Elas possuem níveis estruturais distintos: primário (sequência de aminoácidos), secundário (alfa-hélices e folhas beta), terciário (dobramento tridimensional) e quaternário (associação de várias subunidades). A estrutura terciária, em particular, é crucial para a atividade enzimática, definindo o sítio ativo onde a mágica acontece.
A forma como a enzima se dobra influencia diretamente sua capacidade de se ligar ao substrato e catalisar reações, tornando-as verdadeiras obras-primas da natureza.
Enzimas: Estrutura e Função: As Enzimas São Exemplo De Que Tipo De Estrutura Proteica
As enzimas são moléculas essenciais para a vida, atuando como catalisadores biológicos que aceleram as reações químicas nos sistemas vivos. Sua compreensão é fundamental para a bioquímica e áreas afins. Este artigo explora a relação intrínseca entre a estrutura proteica das enzimas e suas funções específicas.
Introdução às Enzimas e Proteínas
As enzimas são, na sua grande maioria, proteínas que desempenham um papel crucial na regulação e aceleração de reações bioquímicas. Sem elas, muitas reações ocorreriam em velocidades extremamente lentas, inviabilizando a vida como a conhecemos. A relação entre enzimas e proteínas é direta: a grande maioria das enzimas são proteínas, ou seja, são formadas por cadeias de aminoácidos. A estrutura proteica, com seus diferentes níveis de organização, determina a função específica de cada enzima.
As proteínas apresentam quatro níveis estruturais principais: a estrutura primária, que é a sequência linear de aminoácidos; a estrutura secundária, que envolve padrões regulares de dobramento da cadeia polipeptídica, como α-hélices e folhas β; a estrutura terciária, que representa o arranjo tridimensional completo da cadeia polipeptídica; e a estrutura quaternária, que descreve a organização de múltiplas subunidades proteicas em um complexo funcional.
Cada nível de estrutura contribui para a forma final e função da proteína, sendo a estrutura terciária, particularmente importante para as enzimas, uma vez que define a formação do sítio ativo.
Classificação das Estruturas Proteicas, As Enzimas São Exemplo De Que Tipo De Estrutura Proteica
As enzimas podem ser classificadas com base em sua estrutura proteica. As principais categorias são proteínas fibrosas e globulares. As enzimas, principalmente, são proteínas globulares, caracterizadas por sua forma compacta e tridimensionalmente complexa, essencial para a formação do sítio ativo e a interação com o substrato. As proteínas fibrosas, por outro lado, tendem a ser mais alongadas e desempenham funções estruturais, como o colágeno.
| Tipo de Estrutura | Exemplo de Enzima | Função da Enzima | Características estruturais |
|---|---|---|---|
| Globular | Tripsina | Digestão de proteínas | Estrutura compacta, sítio ativo bem definido. |
| Globular | Hexoquinase | Fosforilação da glicose | Estrutura globular com domínios específicos para ligação do substrato e ATP. |
| Globular | Catalase | Decomposição do peróxido de hidrogênio | Estrutura tetramérica com grupo heme no sítio ativo. |
| Fibrosa (menos comum em enzimas) | Colágeno (não é uma enzima, exemplo para contraste) | Estrutura de tecidos conjuntivos | Cadeias polipeptídicas alongadas, arranjo paralelo. |
Enzimas com estruturas globulares, por sua natureza compacta e flexível, demonstram maior diversidade funcional e especificidade em comparação com enzimas com estruturas fibrosas. A flexibilidade da estrutura globular permite ajustes conformacionais essenciais para a catálise enzimática.
Aminoácidos como serina, cisteína, histidina, aspartato e glutamato são frequentemente encontrados no sítio ativo de enzimas, desempenhando papéis cruciais na catálise, através de interações com o substrato e na formação de intermediários de reação. Sua importância reside na capacidade de formar ligações de hidrogênio, interações iônicas e outras interações fracas essenciais para a atividade enzimática.
Estrutura Tridimensional e Função Enzimática
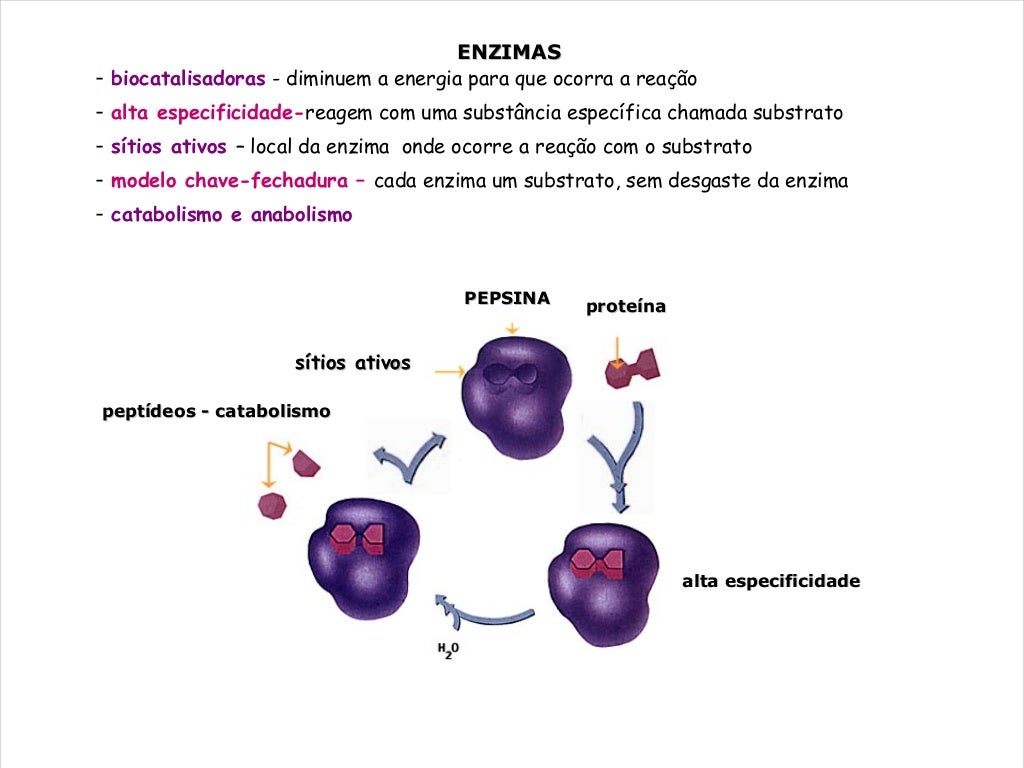
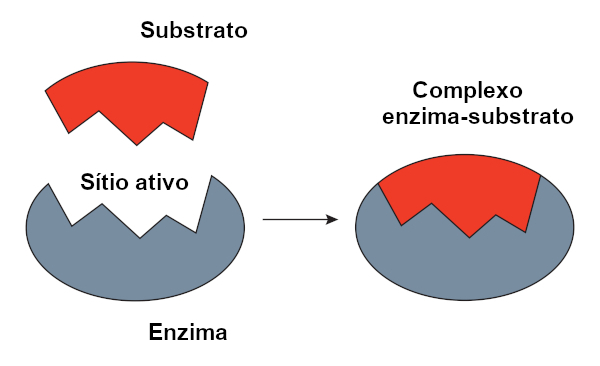
A estrutura tridimensional precisa de uma enzima é crucial para sua especificidade pelo substrato. O encaixe perfeito entre a enzima e o substrato, conhecido como modelo chave-fechadura, ou o modelo mais dinâmico do encaixe induzido, garante que apenas o substrato correto se ligue ao sítio ativo, iniciando a reação catalítica. A estrutura terciária, com seu arranjo espacial único de aminoácidos, cria um microambiente específico no sítio ativo, otimizando a interação com o substrato e a reação subsequente.
O sítio ativo é uma região tridimensional específica na superfície da enzima onde ocorre a ligação do substrato e a catálise. É uma depressão ou fenda na estrutura terciária, formada por um conjunto específico de aminoácidos, que interagem diretamente com o substrato. A catálise enzimática depende da interação precisa entre o sítio ativo e o substrato, que leva a uma diminuição da energia de ativação da reação.
Imagine uma enzima com um sítio ativo em forma de cavidade, com aminoácidos específicos posicionados para interagir com grupos funcionais específicos do substrato. Ao se ligar ao sítio ativo, o substrato sofre uma mudança conformacional induzida pela enzima, facilitando a formação do complexo enzima-substrato e a subsequente reação catalítica. Após a reação, o produto é liberado, e a enzima retorna à sua conformação original, pronta para catalisar outra reação.
Exemplos de Enzimas e suas Estruturas
Diversas enzimas demonstram a complexa relação entre estrutura e função. Aqui estão alguns exemplos:
- Tripsina: Enzima digestiva com estrutura globular, rica em α-hélices e folhas β, com um sítio ativo contendo serina, crucial para sua atividade proteolítica.
- Hexoquinase: Enzima envolvida no metabolismo da glicose, com estrutura globular que sofre alterações conformacionais ao se ligar à glicose e ao ATP.
- Catalase: Enzima que decompõe o peróxido de hidrogênio, com estrutura tetramérica (quatro subunidades), cada uma contendo um grupo heme no sítio ativo.
- DNA polimerase: Enzima que replica o DNA, com estrutura complexa, incluindo múltiplas subunidades e domínios que interagem com o DNA e os nucleotídeos.
- RNA polimerase: Enzima que sintetiza RNA, com uma estrutura complexa que interage com o DNA e os ribonucleotídeos.
Enzimas alostéricas possuem sítios alostéricos adicionais, além do sítio ativo, onde moléculas efetoras podem se ligar e modular a atividade enzimática. Enzimas não alostéricas não apresentam esses sítios reguladores. A ligação de um efetor alostérico causa uma mudança conformacional na enzima, alterando a afinidade pelo substrato e, consequentemente, a atividade catalítica. A fosfofrutoquinase, uma enzima alostérica chave na glicólise, é um exemplo clássico.
Muitas enzimas requerem cofatores ou grupos prostéticos para sua atividade. Por exemplo, a catalase utiliza um grupo heme como cofator, essencial para sua função de decomposição do peróxido de hidrogênio.
Fatores que Afetam a Estrutura e Atividade Enzimática
Vários fatores ambientais podem influenciar a estrutura e a atividade enzimática. Alterações nessas condições podem levar à desnaturação, perda de atividade e consequentemente, falhas em processos biológicos.
O pH e a temperatura afetam as interações fracas (ligações de hidrogênio, interações iônicas) que estabilizam a estrutura terciária das enzimas. Valores extremos de pH ou temperatura podem desnaturar a enzima, alterando sua forma tridimensional e, consequentemente, a atividade catalítica. Cada enzima possui um pH e uma temperatura ótimos para sua atividade máxima.
Inibidores enzimáticos são moléculas que diminuem ou impedem a atividade enzimática. Eles podem se ligar ao sítio ativo (inibidores competitivos) ou a outros sítios na enzima (inibidores não competitivos), alterando a estrutura da enzima e sua capacidade de interagir com o substrato. Os inibidores podem ser reversíveis ou irreversíveis, dependendo da natureza da ligação com a enzima.
A desnaturação proteica é a perda da estrutura tridimensional de uma proteína, geralmente causada por mudanças extremas de temperatura ou pH. Isso resulta na perda da atividade enzimática, pois a estrutura tridimensional é essencial para a formação do sítio ativo e a interação com o substrato. A desnaturação pode ser reversível ou irreversível, dependendo da extensão da alteração na estrutura da proteína.

